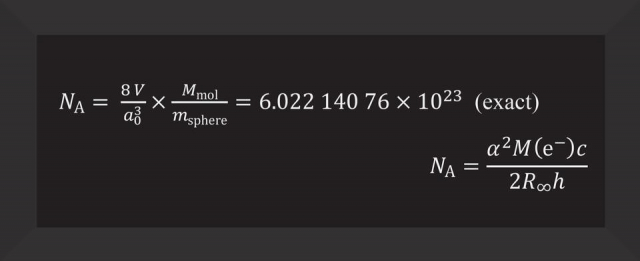图:1摩尔精确包含6.022 140 76×1023个基本单元。该数称为阿伏伽德罗数NA
602 214 076 000 000 000 000 000,这个数大约是602万兆,共有24位数。尽管这个数看起来大得无法想象,但其实我们在日常生活中经常遇到数万兆的事物!
举个例子,在一个标准的气球中有大约50万兆个空气分子(这意味着有大约39万兆个氮分子、10万兆个氧分子和5万兆个氩原子)。一粒标准的止痛药中有大约1.7万兆个活性成分分子,例如乙酰水杨酸。一升矿泉水中有大约1万兆个钠离子。
正如你所看到的:当我们在分析原子和分子这类极微小的物质时,会很容易出现这种极大的数。在物理学和化学中,科学家们经常跟分子和原子打交道,但他们并想总是摆弄如此大的数。这就是为什么大的粒子数会被一种“假想计数组”替代的原因,这个计数组就是国际单位制中的基本单位 - 摩尔,也就是物质的量的单位。
通过使用摩尔,粒子数可以用一种更易于管理的方式来表示。我们可以说“一个气球里有大约0.02摩尔的氧气”,而不是说“一个气球里大约有10万兆个氧分子”。
粒子数和物质的量之间的转换因子(以我们特定计数组的方式)就是所谓的阿伏伽德罗常数NA。这表明1摩尔含有602 214 076 000 000 000 000 000个粒子。
虽说我们通常并不关心一个气球中的氧原子数量,但是在药品或食品,以及生活的许多其他领域,了解某种特定物质究竟有多少是很重要的。
例如,在药学和分析化学中时时刻刻都会用到物质的量和所谓的摩尔量,因为用“0.01摩尔每升”来计算比起使用“602 214 076 000 000 000 000个粒子每升”要容易得多。
20世纪初,在引入一个单位为“摩尔”的物理量来表示物质的量之前,人们用“克原子”和“克分子”等术语来描述化学元素或化合物的数量。这些数量是指相对的原子或分子(重)量,而相对重量的参考值则是氧原子的原子量,人们通常认为它等于16。
之后,由于物理学和化学对氧的确切含义产生了一些分歧[1],因此,国际纯粹与应用物理联合会(IUPAP)和国际纯粹与应用化学联合会(IUPAC)于1960年同意,将质量数为12的碳的同位素[2] (12C)的所谓的原子量设定为12,正确的说法应该是相对原子质量Ar(12C)为12。从那时起,Ar(12C)便被用作元素原子量的参考值。
在IUPAP、IUPAC和国际标准化组织(ISO)的建议下,20世纪60年代末,摩尔作为物质的量的单位被正式定义。1971年第14届国际计量大会(CGPM)决定,国际单位制(SI)采用该定义,并一直使用到今天,直至2019年5月19日。这个定义如下:
摩尔是一个系统中物质的量,该系统含有与0.012千克碳12的原子一样多的基本单元,其符号为“mol”。
当使用摩尔这个单位时,基本单元必须被明确说明,它可以是原子、分子、离子、电子、其他粒子或这些粒子的特定粒子群。

自2019年5月20日起,修订后的摩尔定义如下:
摩尔,国际单位制中的物质的量的单位,符号mol。1摩尔精确包含6.022 140 76×1023个基本单元。该数称为阿伏伽德罗数,为以单位mol-1表示的阿伏伽德罗常数NA的固定数值。
一个系统的物质的量,符号n,是该系统包含的特定基本单元数的量度。基本单元可以是原子、分子、离子、电子、其它任意粒子或粒子的特定组合。
定义的变化对于摩尔意味着什么呢?乍一看这两个定义看起来非常不同,但实际上变化并不多。对于所有其他基本单位,从5月20日起,常数将成为其定义的基础。对于物质的量及其单位摩尔来说,用于定义的常数就是阿伏伽德罗常数。虽然在2019年5月20日之前有效的定义中没有明确提及这个常数,但它与当前的定义是密切相关的,因为阿伏伽德罗常数对应着12g碳同位素12C中包含的粒子数。
图:意大利物理学家、化学家阿莫迪欧·阿伏伽德罗
通过摩尔这个单位能够清楚地说明多的事物究竟是多还是少。让我们取602万兆个(或1摩尔)水分子,所有这些分子都能够放进一个鸡蛋杯里。
但是,如果你仅取0.01摩尔的鸡蛋并把它们相互垂直放置,你可以覆盖一个与太阳表面一样大的区域[3]。那得有多少的鸡蛋啊!或者这样说吧,假使今天活着的每个人每分钟都能找到一个复活节彩蛋,要想找到1摩尔的复活节彩蛋需要这么多人花上一亿年的时间。
(1)氧在自然界中有三种不同的同位素。通过物理测量方法,这些同位素因质量不同而可以被分离。在物理学中,最轻的氧同位素被赋予16的值。而在化学中,16的值被赋予同位素的天然混合物,也就是自然存在的元素氧。
(2)一种元素的同位素在原子核中有相同数量的质子,不同数量的中子。因此,一种元素不同同位素的原子具有不同的重量。氧有三种不同的天然同位素,原子核中都有8个质子,同位素16O有8个中子,17O有9个中子, 18O有10个中子。
(3)用1摩尔的鸡蛋可以在太阳表面紧密堆放100层。这当然只是一个思维实验!实际实施将有许多困难的边界条件,还会产生大量被太阳炒熟的鸡蛋。
原文来源:欧洲计量组织(EURAMET)
英文链接:https://www.euramet.org/si-redefinition/countdown-si-redefinition/the-mole/